at beregneTm (den temperatur, hvor halvdelen af
primeren vii vrere bundet til DNA-template).
I
mange tilfrelde må man dog pr!1)ve sig frem, da
"stacking" interaktionerne i heteroduplexen er
vanskelige at forudsige fra en linrer sekvens. Som
en tommelfingerregel kanman antage, at en 20mer
primer med et guanosin og cytosin indhold på ca.
55% giver en annealing-temperatur i omegnen af
55
°C.
Magnesiumkoncentrationen skal normalt
vrere 1.5 mM, men det er en god ide at titrere
mrengden fra 0.5-2.0 mM.
PCR rummer to indbyggede problemer, hvoraf
det ene er relateret til Taq-polymerasens dårlige
"proof-reading", og det andet skyldes metodens
enorme f!lllsomhed, dermedf!1)rer en stor risiko for
amplifikation afuvedkommendeDNA.
I
modsret–
ning til Klenow polymerase, der laver i st!1)rrelses–
ordenen
l
fejl ud af 170.000 nukleotider, vii
Taq
normalt indbygge et forkert nukleotid hver 9000
base.
I
nogle tilfrelde, nårkoncentrationen afdNTP
er h!llj eller uensartet, kan fejlraten komme helt op
PCR-cyklus
på l per 500base (4). I praksis betyder det, at man
b!llr vrere varsommed at bruge PCR ved kloning–
er, da der er meget stor sandsynlighed for, at det
klonede produkt vii indeholde fejl. Mange vrelger
da også at benytte alternative termostabile poly–
meraser som f.eks.
Pvu,
der har en bedre "proof–
reading" ved PCR kloning.
Kontaminationsrisikoen eren afde st!1)rste vans–
keligheder ved brugen afPCR til patient diagnos–
tik (4,5). At eliminere dette problem er en udford–
ring ved kvalitetssikringen af den molekylrerge–
netiske diagnostik. Kontaminering forekoromer
ofte når laboratoriet har vreret igangnogen tidmed
de samme analyser. Man vii opdage, at der i kon–
trolpr!llver,hvorDNA-template udelades, forekom–
mer et amplifikat, der er identiskmed det, der ge–
nereres ipatientpr!1)verne.Det amplificeredeDNA
vii i nogle tilfrelde vrere genomiskDNA fra labo–
ranten, men oftere vii det dreje sig om amplifice–
ret DNA fra tidligere reaktioner. Kontaminations–
risikoen medf!1)rer, at man ofte må adskille PCR
1. Denaturering
(9s•c ,
1min)
2. Primer-annealing
(So·c , 1
min)
3.
~kstension
(72•c, 2
min)
_.) 5'
cDNA-syntese
1.Annealing
s·-~
.....
3'
3'- s·
~:-
3'
5'
~:~-~:
m
RNA
5..
------~~----------.
~
3'- 5'
2.
Ekstension
5'.3:3========::~
-3
- s·
c
DNA
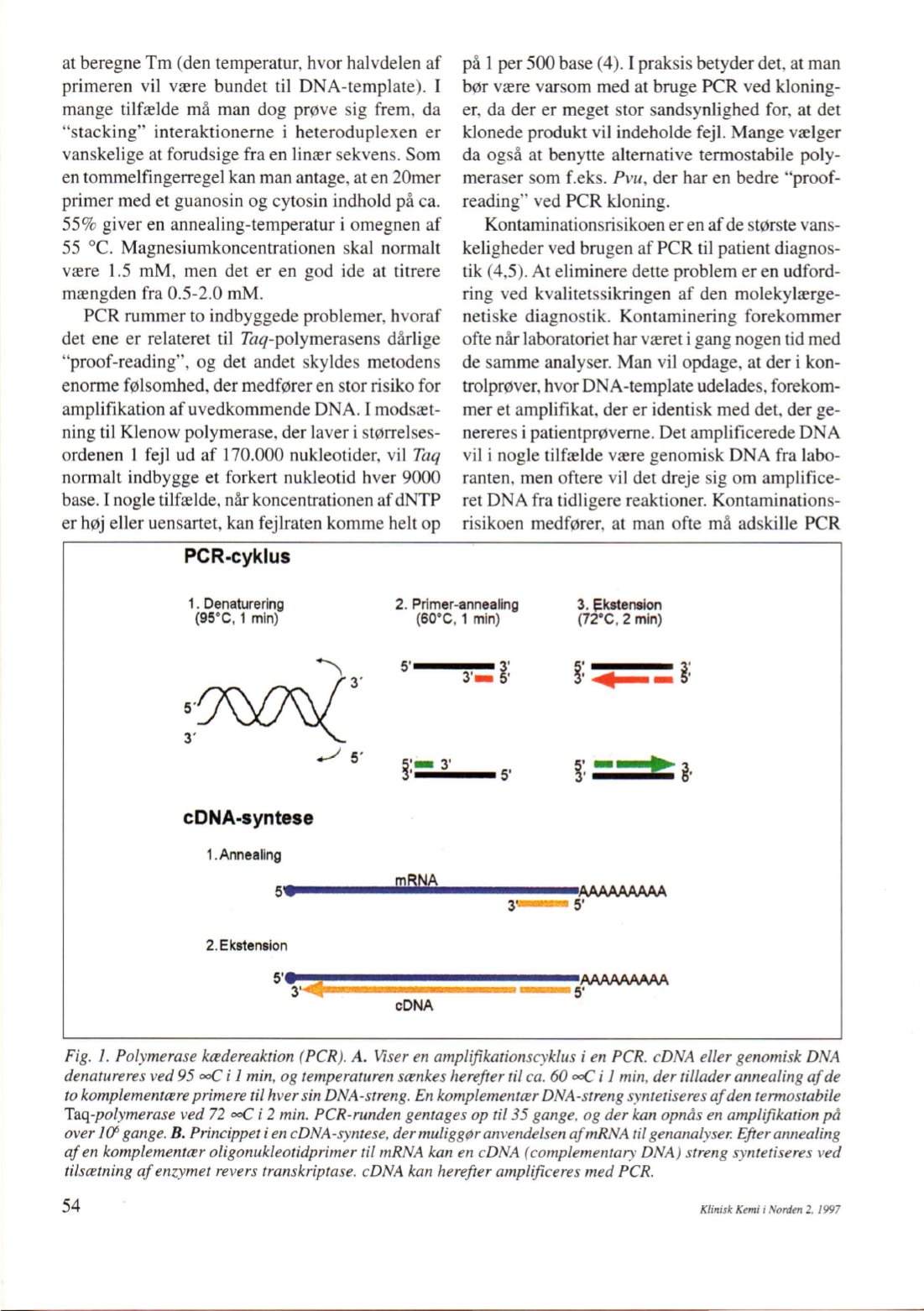
Fig.
l.
Polymerase ktedereaktion (PCR). A. Viseren amplifikationscyklus
i
en PCR. cDNA eller genomisk DNA
denatureres ved95
ooC
i
l min, og temperaturen scenkes herefter til ca. 60
ooC
i
J
min, der tiltader annealingafde
to komplementrereprimere til hversinDNA-streng. En komplementrerDNA-streng syntetiseresafden termostabile
Taq-polymerase ved 72
ooC
i
2min. PCR-runden gentagesop ti/35 gange, og der kan opnås en amplifikation på
over l
(J
gange. B. Princippet
i
encDNA-syntese, dermuliggpranvendelsenafmRNA
t
ilgenanalyser. Efterannealing
afen komplementrer oligonukleotidprimer til mRNA kan en cDNA (complementary DNA) streng syntetiseres ved
tilscetning afenzymet revers transkriptase. cDNA kan herefter amplificeres med PCR.
54
Klinisk Kemi
i
Norden
2,
1997


