Klinisk Biokemi i Norden · 3 2013
| 25
Protein C
För drygt 10 år sedan tog vi fram en både enkel och
känslig metod för att mäta graden av aktivering av
blodkoagulationen, med målsättningen att den skulle
vara möjlig att automatisera och därmed kunna infö-
ras i klinisk rutindiagnostik. Då var det naturligt att
Protein C systemet kom i fokus för intresset; Protein
C var ju ”fött” i Malmö (4, 5).
Protein C och dess funktion är beskriven i en tidigare
artikel, varför det här räcker med att påpeka att Protein
C är ett K-vitaminberoende protein, som strukturellt
liknar de K-vitaminberoende koagulationsfaktorerna
VII, IX och X (4). Liksom dessa är Protein C ett pro-
enzym till ett serinproteas, men med en extremt snäv
specificitet. Av zymogenet, Protein C, har vi ungefär 4
mg/L plasma, medan vi endast har cirka 1 µg/L plasma
aktivt Protein C (APC) (6). Vi vet också sedan länge
att vi inte kan leva utan detta mikrogram APC – utan
det dör vi av trombotisk obliterering av vensystemet
inom en halvtimme. Det förekommer vid den mycket
ovanliga homozygota formen av Protein C brist, men
även vid särskilt alvarliga former av sepsis på grund av
att Protein C har förbrukats, eller därför att Protein C
inte kan aktiveras på grund av endotelskador (7, 8).
I kapillärsystemet binds Protein C till ett mem-
branprotein, den endoteliala Protein C receptorn,
och aktiveras av trombin, som är bundet till en annan
receptor, trombomodulin (TM) (9). Bindningen till
TM gör att trombinet inte kan klyva fibrinogen men
väl aktivera Protein C. Trombinet har alltså omvand-
lats
från att ha varit ett prokoagulant enzym till att
bli ett antikoagulant enzym
. Gemensamt gör de båda
receptorerna att den trombin-medierade aktiveringen
av Protein C går cirka 20 000 gånger snabbare än vad
som varit fallet om proteinerna inte varit bundna till
respektive receptor (9).
APC, som är bundet till fosfolipid, klyver tre peptid-
bindningar i faktor Va (Arg 306, Arg 506 och Arg 679).
Klyvningen vid Arg 306 är långsam och helt beroende
av närvaro av fosfolipid och av den K-vitaminberoende
kofaktorn, Protein S. Inaktiveringen av faktor VIIIa är
mer komplicerad och inte bara beroende av Protein
S som kofaktor utan även av icke aktiverad Faktor V.
Klyvningen av Faktorerna Va och VIIIa leder till en
minskad aktivering av såväl faktor X som protrombin
och därmed till en nedreglering av blodkoagulatio-
nen. (7, 8).
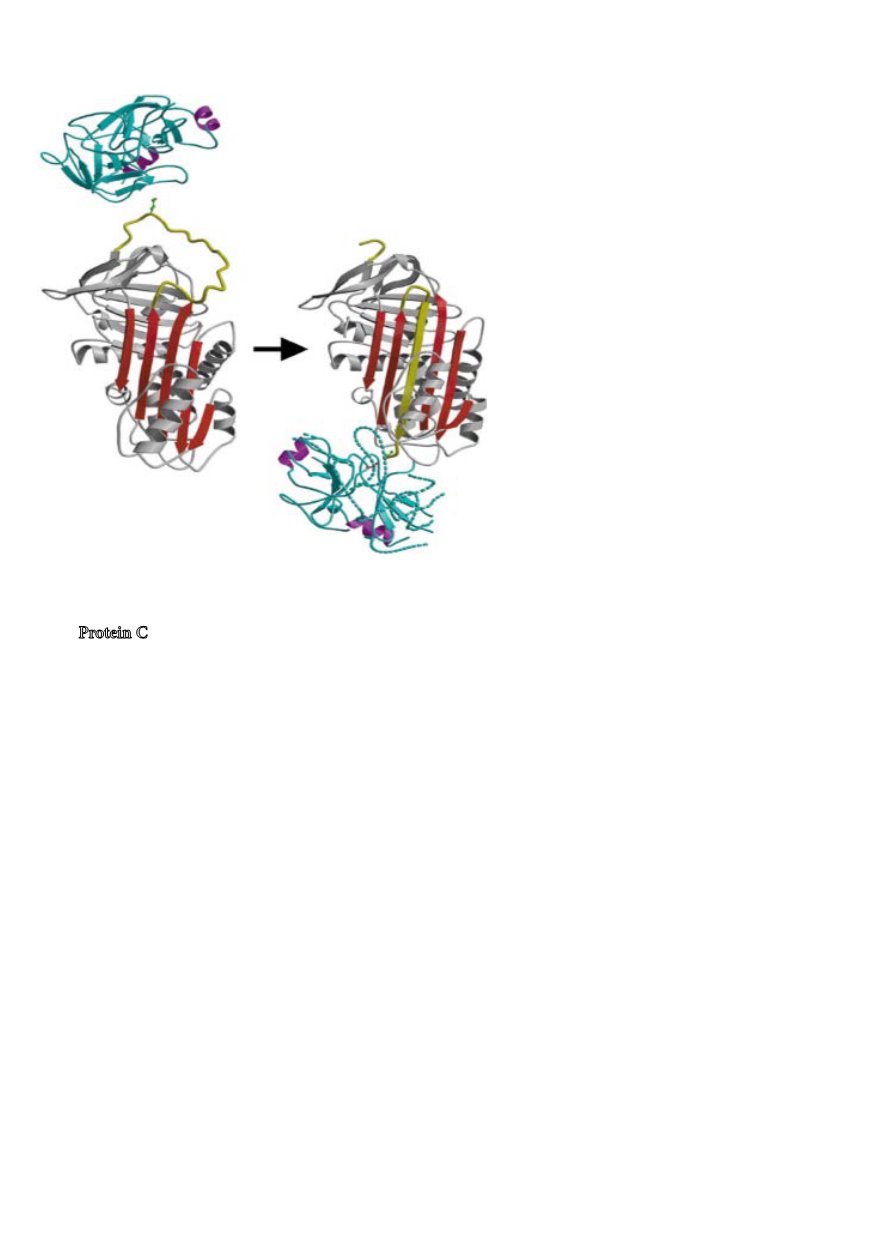
Fig. 1.
Figuren visar hur komplexbildningen mellan ett
serinproteas och en serinproteashämmre, ett så kallat
serpin, går till, t.ex. mellan trombin och antitrombin,
som i figuren, eller mellan aktivt Protein C (APC)
och protein C hämmaren (PCI). I den vänstra delen
av figuren ser vi proteaset överst, blått, och serpinet
därunder, rött. Mitt på den gula loopen hos serpinet
ser vi den aminosyra vid vilken klyvningen ska ske,
arginin, som pekar upp mot enzymet. Vid klyvningen
bildas en kovalent bindning mellan hydroxygruppen i
enzymets aktiva site och karboxylgruppen i serpinets
arginin, vid vilken klyvningen ska ske. Vid normal
proteolys klyvs bindningen av en –OH med följd att det
bildats ett kluvet substrat och ett fritt enzym. Vid reak-
tionen mellan proteaset och serpinet hinner inte bind-
ningen mellan aktiva siten i enzymet och karboxyl-
gruppen i den arginin i serpinet, vid vilken klyvningen
sker, klyvas innan enzymet kastas ned till den motsatta
polen av serpinet. Härvid denatureras enzymet så att
bindningen mellan enzym och hämmare inte kan kly-
vas. Det har alltså bildats ett kovalent komplex mellan
serpinet och det nu inaktiverade enzymet. I den högra
delen av figuren ser vi hur den kluvna, gula loopen i
serpinet nu är insatt i den röda, så kallade betapleated
sheeten, medan det denaturerade enzymet är längst
ner. I stället för en kluven peptidbindning i ett substrat
och ett fritt enzym har det i stället blivit ett kovalent
komplex mellan substratet/hämmaren och det nu inak-
tiverade enzymet
1
.


